Валент электрондар
| Валент электрондар | |
| Ҡапма-ҡаршыһы | ядерный электрон[d] |
|---|---|

Валент электрондар — атомдың тышҡы электрон көплөгөндә урынлашҡан иң юғары энергиялы электрондар.
Юғары энергияһына эйә булғанға күрә валент электрондар химик реакцияларҙа атом ғәмәлдәрен билдәләй. Әгәр элементта аҙ валент электрондар булһа, ул икенсе элементтар менән реакцияларҙа был электрондарын еңелерәк бирә һәм тергеҙеүсе матдә үҙенсәлеген күрһәтә. Киреһенсә, химик элементта күберәк валент электрондар булһа, ул икенсе элементтар менән реакцияларҙа электрондарҙы еңелерәк ала, сөнки тигеҙ шарттарҙа оксидлаштырыусы сифатын күрһәтә.
Инерт газдарҙың тышҡы электрон көплөктәре тулыһынса тултырылған һәм минималь химик активлығын күрһәтә. Тышҡы электрон көплөктө электрондар менән тултырыу йышлығы Менделеев таблицаһында элементтарҙың химик үҙенсәлектәренең периодик үҙгәреүен билдәләй.
Валент электрондар һаны (максималь валентлыҡ) элементтың Менделеевтың периодик таблицаһындағы төркөмө номерына тигеҙ (3-12 төркөмдән — күсеүсән металдарҙан башҡаһы).
Эске көплөклө электрон кеүек үк, валентлыҡ электроны фотон формаһында энергияны йотоу йәки бүлеп сығарыу һәләтенә эйә. Энергия алыу электронды тышҡы көплөккә күсергә мәжбүр итергә мөмкин; был ваҡиға ҡуҙғыу (рус. возбуждение) булараҡ билдәле. Шул уҡ ваҡытта, әгәр ҙә электрон ионлашыу потенциалына тигеҙ потенциаль кәртәне еңеү өсөн етерлек энергия алһа, ул атомды ташлап китә, шул рәүешле ыңғай ион барлыҡҡа килтерә. Электрон үҙенең энергияһын юғалтҡан осраҡта (фотонын нурландырып), ул тулы булмаған эске көплөккә күсеүе мөмкин.
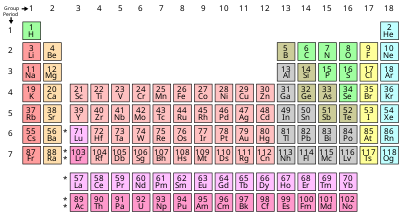
| Периодик таблицаның төркөмө | Валент электрондар |
|---|---|
| Төркөм 1 (I) (һелтеле металдар) | 1 |
| Төркөм 2 (II) (һелтеле-ер металдары) | 2 |
| Төркөм 3-12 (күсеүсән металдар) | 3-12[1] |
| Төркөм 13 (III) | 3 |
| Төркөм (IV) | 4 |
| Төркөм 15 (V) | 5 |
| Төркөм 16 (VI) | 6 |
| Төркөм 17 (VII) (галогендар) | 7 |
| Төркөм 18 (VIII яки 0) (инерт газдар) | 8[2] |
Әҙәбиәт[үҙгәртергә | сығанаҡты үҙгәртеү]
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
Иҫкәрмәләр[үҙгәртергә | сығанаҡты үҙгәртеү]
Һылтанмалар[үҙгәртергә | сығанаҡты үҙгәртеү]
- Валентность//Большая российская энциклопедия(недоступная ссылка)
- Francis, Eden. Valence Electrons.
