Периодик системаның беренсе периоды
| Периодик системаның беренсе периоды | |
 | |
| Тәртип буйынса һуңыраҡ килеүсе | периодик системаның икенсе периоды[d] |
|---|---|
Периодик системаның беренсе периодына — химик элементтарҙың периодик таблицаһының өҫкө юлы (йәки периоды) элементтары инә. Периодик таблицаның төҙөлөшө элементтарҙың атом һаны артҡан һайын ҡабатланыусы (периодик) химик үҙсәнлектәрен һүрәтләү өсөн рәттәргә нигеҙләнгән: энергия кимәле артҡандан һуң яңы рәт башлана, тимәк, оҡшаш үҙенсәлектәргә эйә булған элементтар бер үк вертикаль бағанаға тура килә. 1-се периодта бары ике генә элемент: гелий һәм водород. Был хәл атом структураһының хәҙерге теорияһы менән аңлатыла.
Периодик үҙсәнлектәр
[үҙгәртергә | сығанаҡты үҙгәртеү]Химик элементтарҙың периодик таблицаһында һәр периодҡа кәм тигәндә 8 элемент инә, һәм был билдәле бер периодтың периодик законын табырға мөмкинлек бирә. Ләкин 1-се период тик 2 элементтан тора, был периодик законды табыу процесын ҡыйынлаштыра.
Гелий затлы газдарға ҡараған 18-се төркөмгә инә. Ә водородтың уникаль үҙсәнлектәре бар, шуға күрә уны ниндәй ҙә булһа төркөмгә бүлеүе ҡыйын. Шуға ла уны йыш ҡына төрлө позицияларҙа ваҡытлы таблицала һүрәтләйҙәр.
Таблицала беренсе период элементтарының позициялары
[үҙгәртергә | сығанаҡты үҙгәртеү]S-блокка водород та, гелий ҙә инһә лә, уларҙың береһенә лә был блоктан оҡшаш үҙенсәлектәргә эйә элемент табып булмай. Уларҙың химик үҙенсәлектәре башҡа элементтарҙан шул тиклем айырыла, ҡайһы берҙә периодик таблицала элементтарҙың торошо ҡарата килешмәүсәнлек килеп тыуа.
Системала водородты ҡайһы берҙә литий, углерод, фтор[1][2] өҫтөнә ҡуялар. Таблицаның ҡайһы бер варианттарында водород символы, ҡағиҙә булараҡ, ике тапҡыр — литий һәм фтор өҫтөндә барлыҡҡа килә.[3] Ҡайһы берҙә был элемент таблицаның аҫҡы периодынан түбән булған бөтә элементтарҙан өҫтөнөрәк ҡуйыла, был химик элемент периодик таблицаның бер төркөмөндә лә бүленмәүен һыҙыҡ өҫтөнә ала.
Гелийҙы һәр ваҡыт тиерлек неон өҫтөндә (п-элементтарға бәйле) 18-се төркөмгә ҡараған затлы газдар булған бағанала урынлаштыралар. Ләкин ваҡыт-ваҡыт бериллий өҫтөндә электрондарҙың тышҡы кимәлдә урынлашыуы конфигурациялы булыу сәбәпле гелий урынлаштырыла.[4]
Элементтар
[үҙгәртергә | сығанаҡты үҙгәртеү]| Химик элемент | Төркөм | Электрон конфигурация | ||
|---|---|---|---|---|
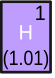
| 1 | H | Водород | Металл булмаған | 1s1 |
| 2 | He | Гелий | Затлы газ | 1s2 |
Водород
[үҙгәртергә | сығанаҡты үҙгәртеү]


Водород (Н) −1-се атом номерлы химик элемент.. Нормаль температурала һәм баҫым аҫтында водород еңел тоҡанып китеүсе төҫһөҙ, еҫһеҙ ике атомлы газ. Металл булмаған, молекуляр формулаһы — H2. Водород — 1,00794 м.а.б. атом ауырлығына тигеҙ булған иң еңел элемент.[5]
Водород — Ғаләмдәге бөтә элементтар массаһының яҡынса 75 процент тәшкил иткән химик элемент[6]. Йондоҙҙар башлыса плазма хәлендәге водородтан тора. Ябай хәлдә водород Ерҙә сағыштырмаса һирәк элемент, шуға күрә сәнәғәт масштабында метан кеүек углеводородтарҙан етештерелә. Элементар водородтың күбеһе «ашығыс» файҙаланыла. Ҡаҙылма яғыулыҡ эшкәртеү, гидрокракинг, аммиак етештереү, башлыса ашламалар баҙары өсөн һ. б. уны һатыуҙың иң ҙур урындары булып тора. Шулай уҡ водородты электролиз процесы ярҙамында һыуҙан алырға мөмкин, ләкин ул ваҡытта водород етештереү тәбиғи газға ҡарағанда күпкә ҡиммәтерәк килеп сыға.[7]
Протий булараҡ билдәле тәбиғи сығанаҡлы водород изотопының бер протоны бар, нейтроны берәү ҙә юҡ.[8] Ионлы берләшмәләрҙә ыңғай заряд алып ул бер протондан торған катионға, йә иһә кире заряд алып гидрид булараҡ билдәле анионға әүерелергә мөмкин. Водород күпселек элементтар менән берләшә ала, ул һыуҙа һәм күпселек органик матдәләрҙә бар. Водород кислоталар һәм нигеҙҙәр химияһында айырыуса мөһим роль уйнай: иретмә молекулалары араһында протондар алмашыу реакциялары булып тора[9]Нейтрал атом өсөн генә Шрёдингер тигеҙләмәһен аналитик юл менән сисергә мөмкин булғанлыҡтан, водород атомының энергетикаһын һәм спектрын өйрәнеү квант механикаһы үҫешендә төп роль уйнай
Водородтың төрлө металдар менән үҙ-ара тәьҫир итешеүе металлургияла бик мөһим, сөнки күп металдар реакция ваҡытында водородлы муртланыу кисерә,[10] ә көн тәртибендә водородты хәүефһеҙ һаҡлау алымдарын үҫтереү һәм уны яғыулыҡ сифатында файҙаланыу тора[11]. Водород һирәк ер һәм күсмә металдарҙың күп кенә берләшмәләрендә юғары эреүсәнлеккә эйә,[12] шул уҡ ваҡытта ул кристаллик, шулай уҡ аморф матдәләрҙә лә эрей ала. Водородтың эреүсәнлеге металдың кристаллик рәшәткәһе локаль боҙолғанда йәки ҡушылмалар булғанда үҙгәрә.[13]
Водородтың төрлө металдар менән үҙ ара тәьҫир итешеүе бик мөһим металлургиялар, сөнки күп металдар реакция ваҡытында кисерә водородлы муртланыу, ә көн тәртибендә водородты хәүефһеҙ һаҡлау ысулдарын үҫтереү һәм уны яғыулыҡ сифатында файҙаланыу тора. Водород һирәк ер һәм күсемле металдарҙың күп берләшмәләрендә юғары эреүсәнлеккә эйә, шул уҡ ваҡытта ул кристалл һәм аморф матдәләрҙә эрей ала. Металдың кристаллик рәшәткәһенең локаль зарарланыуы йәки ҡушылмалар булғанда водородтың эреүсәнлеге үҙгәрә.
Гелий
[үҙгәртергә | сығанаҡты үҙгәртеү]
Гелий (He) бер атомлы инерт химик элемент, атом номеры 2, төҫһөҙ, тәме һәм еҫе юҡ, ағыулы түгел, периодик таблицала заатлы газдар төркөмө башында тора[14] Уның ҡайнау һәм иреү температураһы бөтә элементтар араһында иң түбәне булып тора, ул, экстремаль шарттарҙан тыш, газ рәүешендә генә бул.[15]
Гелийҙы 1868 йылда француз астрономы Пьер Жансен аса. Ул ҡояш тотолған ваҡытта билдәле булмаған һары спектраль ҡояш нуры линияһы барлығы буйынса ошо элементты тәүгеләрҙән булып таба. 1903 йылда АҠШ-та тәбиғи газ ятҡылығында гелийҙың ҙур запастары табыла. Бөгөнгө көндә АҠШ был газ менән иң эре тәьмин итеүсе булып тора.. Гелий криоген техникала[16], тәрән һыулы тын алыу системаларында,[17]юғары үткәреүсән магниттарҙы һыуытыу өсөн, һауа шарҙарын өрҙөрөү өсөн, дирижабләләрҙе күтәреү өсөн, шулай уҡ электр менән иретеп йәбештереү һәм кремний пластиналарын үҫтереү кеүек сәнәғәт маҡсатында һаҡлағыс газ сифатында файҙаланыла. Ҙур булмаған күләмдәге газды ингаляциялап, кеше тауышының тембрын һәм сифатын ваҡытлыса үҙгәртергә мөмкин. I һәм гелий II шыйыҡ фазаларында шыйыҡ гелий-4 тәртибе квант механикаһын һәм үтә һығылмалылыҡ күренештәрен өйрәнеүсе, шулай уҡ юғары үткәреүсәнлек кеүек абсолют нулгә яҡын температурала һөҙөмтәләрҙе тикшереүселәр өсөн мөһим.[18]
Гелий Ғаләмдең еңеллеге һәм таралышы буйынса икенсе элемент булып тора.[19] Гелий күберәк ҙур шартлау ваҡытында барлыҡҡа килә, ләкин яңы гелий ҙа даими рәүештә йондоҙҙарҙа водород ядроһының ҡушылыуы һөҙөмтәһендә барлыҡҡа килә[20]. Ерҙә гелий сағыштырмаса һирәк. Ул ҡайһы бер радиоактив элементтарҙың тәбиғи тарҡалыуы һөҙөмтәһендә барлыҡҡа килә,[21] сөнки был осраҡта бүленеп сыҡҡан альфа-өлөшсәләр гелий ядроһынан тора. Был радиоген гелий тәбиғи газда фракциялы дистилляция тип аталған түбән температуралы айырыу процесы аша коммерция масштанда сығарылған күләмдең ете процентына тиклем концентрацияла алына[22].
Периодик таблицаның традицион һүрәтләнешендә гелий неондан юғарыраҡ, ул затлы газ статусын сағылдыра, әммә ҡайһы берҙә, Менделеевтың Джанет таблицаһындағы кеүек, уның электрон конфигурацияһы структураһын сағылдырған бериллий өҫтөндә тора.
Иҫкәрмәләр
[үҙгәртергә | сығанаҡты үҙгәртеү]- ↑ Cronyn, Marshall W. The Proper Place for Hydrogen in the Periodic Table (инг.) // Journal of Chemical Education (инг.)баш. : journal. — 2003. — Т. 80. — № 8. — С. 947—951. — DOI:10.1021/ed080p947 —
- ↑ Vinson, Greg. Hydrogen is a Halogen. HydrogenTwo.com (2008). Дата обращения: 14 ғинуар 2012. Архивировано 10 ғинуар 2012 года.
- ↑ Kaesz, Herb; Atkins, Peter A Central Position for Hydrogen in the Periodic Table (инг.) // Chemistry International (инг.)баш. : journal. — International Union of Pure and Applied Chemistry. — Т. 25. — № 6. — С. 14.
- ↑ Winter, Mark. Janet periodic table. 1993–2011. WebElements. Дата обращения: 19 ғинуар 2012. Архивировано из оригинала 6 апрель 2012 года. 2012 йыл 6 апрель архивланған.
- ↑ Hydrogen – Energy. Energy Information Administration. Дата обращения: 20 апрель 2011. Архивировано 5 февраль 2009 года.
- ↑ Palmer, David Hydrogen in the Universe. NASA (13 ноябрь 1997). Дата обращения: 20 апрель 2011. Архивировано 29 октябрь 2014 года.
- ↑ Staff. Hydrogen Basics — Production. Florida Solar Energy Center. Дата обращения: 20 апрель 2011. Архивировано 22 октябрь 2018 года.
- ↑ Sullivan, Walter. Fusion Power Is Still Facing Formidable Difficulties, The New York Times (11 март 1971).
- ↑ Eustis, S. N.; Radisic, D; Bowen, KH; Bachorz, RA; Haranczyk, M; Schenter, GK; Gutowski, M. Electron-Driven Acid-Base Chemistry: Proton Transfer from Hydrogen Chloride to Ammonia (инг.) // Science : journal. — 2008. — Т. 319. — № 5865. — С. 936—939. — DOI:10.1126/science.1151614 — PMID 18276886.
- ↑ Rogers, H. C. Hydrogen Embrittlement of Metals (инг.) // Science. — 1999. — Т. 159. — № 3819. — С. 1057—1064. — DOI:10.1126/science.159.3819.1057 — PMID 17775040.
- ↑ Christensen, C. H., Nørskov, J. K.; Johannessen, T.. Making society independent of fossil fuels — Danish researchers reveal new technology, Technical University of Denmark (9 июль 2005).
- ↑ Takeshita, T.; Wallace, W.E.; Craig, R.S. Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt (инг.) // Inorganic Chemistry : journal. — 1974. — Т. 13. — № 9. — С. 2282—2283. — DOI:10.1021/ic50139a050
- ↑ Kirchheim, R. Hydrogen solubility and diffusivity in defective and amorphous metals (инг.) // Progress in Materials Science (инг.)баш. : journal. — 1988. — Т. 32. — № 4. — С. 262—325. — DOI:10.1016/0079-6425(88)90010-2
- ↑ Helium: the essentials. WebElements. Дата обращения: 20 апрель 2011. Архивировано 14 июль 2008 года.
- ↑ Helium: physical properties. WebElements. Дата обращения: 20 апрель 2011. Архивировано 25 ноябрь 2017 года.
- ↑ Timmerhaus, Klaus D. Cryogenic Engineering: Fifty Years of Progress. — Springer (инг.)баш., 2006. — ISBN 0-387-33324-X.
- ↑ Copel, M. Helium voice unscrambling (билдәһеҙ) // Audio and Electroacoustics. — 1966. — Т. 14. — № 3. — С. 122—126. — DOI:10.1109/TAU.1966.1161862
- ↑ Browne, Malcolm W.. Scientists See Peril In Wasting Helium; Scientists See Peril in Waste of Helium, The New York Times (21 август 1979).
- ↑ Helium: geological information. WebElements. Дата обращения: 20 апрель 2011. Архивировано 4 август 2020 года.
- ↑ Cox, Tony. Origin of the chemical elements. 1990-02-03. New Scientist. Дата обращения: 2 октябрь 2017. Архивировано 21 октябрь 2014 года.
- ↑ Helium supply deflated: production shortages mean some industries and partygoers must squeak by., Houston Chronicle (5 ноябрь 2006).
- ↑ Voth, Greg. Where Do We Get the Helium We Use?, The Science Teacher (1 декабрь 2006).
Һылтанмалар
[үҙгәртергә | сығанаҡты үҙгәртеү]- Левченков С. И. Химия тарихының Ҡыҫҡаса очеркы. 2013 йыл 30 ғинуар архивланған. Архивная копия 2013 йылдың 30 ғинуарынан на Wayback Machine
- Bloch, D. R. Organic Chemistry Demystified. — McGraw-Hill Professional, 2006. — ISBN 0-07-145920-0.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||||
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||